Краткая информация о проекте
(2023-2025 гг.)
Наименование проекта: ИРН АР19676010 «Разработка биотехнологии сохранения ex—situ редких, исчезающих видов растений семейства Rosaceae, для восстановления природных популяций».
Актуальность. Проблема, на исследование которой направлен проект заключается в том, что на данный момент некоторые виды растений семейства Rosaceae являются исчезающими в Казахстане: Абрикос обыкновенный (Prunus armeniaca L.), Афлатуния вязолистая (Louiseania ulmifolia (Franch.) Pachom), Боярышник сомнительный (Crataegus ambigua C.A. Mey. ex A. Beck), Кизильник каратавский (Cotoneaster karatavikus Pojark.), Миндаль ледебуровский (Amygdalus ledebouriana Schlecht.), Рябина персидская (Sorbus persica Hedl.), Шиповник Павлова (Rosa pavlovii Chrshan.), Яблоня Недзвецкого (Malus niedzwetzkyana Dieck.), Яблоня Сиверса (Malus sieversii (Ledeb.) M. Roem.) и другие. Основной причиной исчезновения растений является хозяйственная деятельность человека, в результате растения погибают в пожарах, при затопления прибережных территорий, при загрязнении окружающей среды и в других экологических катастрофах. Гибель растений в больших количествах ведет к их исчезновению и к глобальным изменениям экосистем. Наиболее уязвимы редкие виды флоры – реликты и эндемики, распространение, которых зависит от границ конкретного ареала.
Многие страны обеспечивают охрану исчезающих растений. Под эгидой Международного союза охраны природы была создана Международная Красная Книга, в которой сосредоточен всемирный аннотированный список исчезающих видов растений и животных. В Казахстане Красная книга является основным законодательным документом, в котором обобщены материалы о современном состоянии редких и находящихся под угрозой исчезновения видов растений и животных. В 2014 году вышло второе отредактированное и дополненное издание Красной книги растений, включающее 387 видов, что на 81 вид больше, чем в первом издании 1981 года. Пополнение списка является результатом усиливающейся за последние годы хозяйственной деятельности человека, в результате которой очевидно дальнейшее сокращение этих видов или даже их исчезновение.
Основные подходы к проведению исследований. Требуется задействования научных подходов сохранения генетического материала исчезающих растений семейства Rosaceae, в том числе и биотехнологическими способами, такими как размножение в культуре in vitro, длительное консервирование в криогенных банках, а также восстановление природных популяций растениями, полученными биотехнологическим путем.
Практическая значимость результатов исследований. Изучаемые растения имеют ценное лекарственное, пищевое, дубильное, декоративное значение, являющиеся важными объектами для селекции, а также источниками генофонда. Сохранение этих растений в культуре in vitro и в криогенном банке, а также восстановление экологии естественных мест их произрастания имеет практическое значение для решения актуальных задач социально-экономического и научно-технического развития Республики Казахстан. Саженцы, полученные в ходе реализации проекта, будут востребованы в селекционной практике, а также могут быть направлены на массовое производство для реализации проекта коммерциализации. Созданная криогенная коллекция и коллекция in vitro могут быть использованы для международного обмена генетическими ресурсами.
Цель проекта: Разработка биотехнологии сохранения в культуре in vitro и криогенном банке гермоплазмы редких, исчезающих видов растений семейства Rosaceae, занесенных в Красную книгу Казахстана, производство саженцев для восстановления природных популяций.
Ожидаемые результаты:
- Сбор растительного материала (однолетние побеги и плоды) растений семейства Rosaceae, занесенных в Красную книгу Казахстана в естественных местах произрастания. Изучение геоботаническими методами состояния исчезающих популяций. Отбор перспективных форм для селекции.
- Введение в культуру in vitro побегов, пророщенных из семян и однолетних побегов. Диагностика пробирочных растений на наличие эндофитной контаминации на специализированной среде 523 для детекции грибов и бактерий. Оптимизация питательных сред для микроклонального размножения и для укоренения побегов в культуре in vitro. Создание коллекции in vitro асептических растений как исходного материала для среднесрочного хранения побегов in vitro при температуре 4°С, длительного сохранения апикальных меристем при -196°С и производства саженцев.
- Оптимизация методов криоконсервации апикальных меристем для некоторых исчезающих видов семейства Rosaceae. Создание криогенного банка семян, изолированных зародышевых осей, апикальных меристем и ДНК при температуре -196°С, длительное сохранение семян в морозильной камере при температуре -20°С.
Научный руководитель проекта: ведущий научный сотрудник лаборатории криосохранения гермоплазмы, кандидат биологических наук, ассоциированный профессор Ромаданова Наталья Владимировна. Опубликовано более 110 научных работ, из них 11 публикаций включены в базу данных Web of Science, 10 – в базу данных Scopus. Индекс Хирша 5. Scopus ID 36111616700; Web of Science ID BBD-5948-2021; ORCiD 0000-0003-1052-2753
Члены исследовательской группы:
- Ведущий научный сотрудник, кандидат биологических наук, профессор Кушнаренко С.В. Опубликовано более 200 научных трудов, из них 18 публикаций включены в базу данных Web of Science, 21 – в базу данных Scopus. Индекс Хирша 9. Scopus ID 6507153914; Web of Science ID M-6616-2015
- Старший научный сотрудник, PhD Александрова А.М. 9 публикаций включены в базу данных Web of Science, Индекс Хирша 3; Web of Science ID AGJ-1822-2022
- Научный сотрудник Төлеген А.Б. Опубликована 12 научных работ, из них 2 публикаций включены в базу данных Web of Science, 2 – в базу данных Scopus. Индекс Хирша 2; Web of Science ID IPO-2780-2023; Scopus ID 57567940600.
- Научный сотрудник Алтаева Н.А. Опубликована 54 научных работ, из них 4 публикаций включены в базу данных Web of Science, 3 – в базу данных Scopus. Индекс Хирша 3. Scopus ID 57216750088; Web of Science ID EKZ-9456-2022; ORCiD 0000-0002-5039-8999.
- Младший научный сотрудник Земцова А.С. Опубликована 5 научных работ.
- Лаборант Михайленко Н.В. Опубликована 2 научных работ.
- Лаборант Артимович Н.А.
Список публикаций и патентов исполнителей проекта за период 2018-2022 гг.
Список основных публикаций руководителя проекта, входящих в базу данных WoS, Scopus и в реферируемых журналах ККСОН МОН РК
- Kushnarenko S.V., Romadanova N.V., Aralbayeva M.M. Current state and in vitro conservation of the only endangered population of Corylus avellana in Kazakhstan // Res. on Crops. – 2020. – Vol. 21 (4). – P. 681-686. IF 0.413 DOI: 10.31830/2348-7542.2020.106 Scopus: индекс цитирования 0, процентиль 18.
- Romadanova N.V., Karasholakova L.N., Eshbakova K.A., Özek G., Özek T., Yur S., Kushnarenko S.V. Phytochemical analysis and antioxidant activity of Berberis iliensis M. Pop and Berberis integerrima Bunge fruits pulp // Res. on Crops. – 2021. – Vol. 22(4). – P. 940-947. IF 0.84 DOI: 10.31830/2348-7542.2021.154 Scopus: индекс цитирования 0, процентиль 38.
- Romadanova N.V., Tolegen A.B., Koken T.E., Nurmanov M.M., Kushnarenko S.V. Chemotherapy of in vitro apple shoots as a method of viruses eradication // International Journal of Biology and Chemistry. – 2021. – Vol. 14, № 1. – P. 48-55. WoS: индекс цитирования 1. DOI: https://doi.org/10.26577/ijbch.2021.v14.i1.04
- 4. Romadanova N.V., Tolegen A.B., Kushnarenko S.V. Effect of Plant Preservative MixtureTM on Endophytic Bacteria Eradication from In Vitro-Grown Apple Shoots // Plants. – 2022. – Vol. 11, Issue19, 2624. IF. 4.658, квартиль 1, процентиль 97. Scopus: индекс цитирования 1, WoS: индекс цитирования 1. DOI: https://doi.org/10.3390/plants11192624
- Ромаданова Н.В., Кушнаренко С.В. Биотехнология получения безвирусных саженцев яблони // Вестник Карагандинского университета. Серия «Биология. Медицина. География». – 2021. – № 3(103). – С. 102-118. DOI 10.31489/2021BMG3/102-118
- Ромаданова Н.В., Аралбаева М.М., Рымханова Н.К., Байгараев Д.Ш., Рамазанов А.К., Ишмуратова М.Ю., Кушнаренко С.В. Криоконсервация как способ повышения лабораторной всхожести и энергии прорастания семян // Вестник Карагандинского университета. Серия «Биология. Медицина. География». – 2022. – № 1 (105). – С. 86-95. DOI: 10.31489/2022BMG1/86-95
- Кушнаренко С.В., Ромаданова Н.В., Турдиев Т.Т., Аралбаева М.М., Қалыбаев Қ.Р. Сохранение в криобанке образцов грецкого ореха из нескольких популяций Сайрам-Угамского государственного национального природного парка // «Вестник КазНУ. Серия экологическая». – 2022. – №2 (71). – С 72-80. DOI: 10.26577/EJE.2022.v71.i2.07
Публикации основного персонала исследовательской группы:
- Alexandrova A.M., Karpova O.V., Nargilova R.M., Kryldakov R.V., Nizkorodova A.S., Zhigaylov A.V., Yekaterinskaya E.M., Kushnarenko S.V., Akbergenov R.Zh., Iskakov B.K. Distribution of potato (Solanum tuberosum) viruses in Kazakhstan // International Journal of Biology and Chemistry. – 2018. – 1 (11). – P. 33-40. DOI: https://doi.org/10.26577/ijbch-2018-1-311. WoS: индекс цитирования 2, квартиль 4.
- Терлецкая Н.В., Зорбекова А.Н., Алтаева Н.А., Бари Г.Т., Ережетова У. Влияние засухи на ростовые параметры и пигментный комплекс линий пшеницы, полученных от межвидовых скрещиваний // Вестник КазНУ им. Аль-Фараби. Серия биологическая. — №3 (76). — 2018. – с.130 – 139.
- Терлецкая Н.В., Алтаева Н.А., Ережетова У. Влияние засухи на функционирование фотосинтетического аппарата флагового листа у аллоплазматических линий, полученных в результате межвидовых скрещиваний пшеницы // Вестник Евразийского национального университета имени Л.Н.Гумилева. Серия Биологические Науки — №4(129). – 2019. – с.58-68.
- 11. Karpova O., Alexandrova A., Yeriskina E., Kryldakov R., Gritsenko D., Galiakparov N., Iskakov B. Andean and Ordinary Strains of Potato Virus S Infecting Potatoes in Southern Kazakhstan // Plant Disease. – 2020. – 104 (2). – P. 599. DOI: 10.1094/pdis-09-19-1822-pdn. IF. 4.614. Scopus: индекс цитирования 0, процентиль 75; WoS: индекс цитирования 0, квартиль 1.
- Терлецкая Н.В., Алтаева Н.А., Ережетова У., Зорбекова А.Н. Морфофизиологические аспекты изучения засухоустойчивости межвидовых гибридов пшеницы // Вестник Казахского Национального Университета им. аль-Фараби, сер. экологическая. — 2020. — №1 (62). — C.36-44.
- Terletskaya N.V., Shcherban A.B., Nesterov M.A., Perfil’ev R.N., Salina E.A., Altayeva N.A., Blavachinskaya I.V. Drought Stress Tolerance and Photosynthetic Activityof Alloplasmic Lines T. dicoccum x T. Aestivum. May 2020. International Journal of Molecular Sciences21(9):3356. DOI: 10.3390/ijms21093356. Scopus: индекс цитирования 12, процентиль 66; WoS: индекс цитирования 9, квартиль1
- 14. Terletskaya N.V., Lee T.E., Altayeva N.A., Kudrina N.O., Blavachinskaya I.V., Erezhetova U. Some Mechanisms Modulating the Root Growth of Various Wheat Species under Osmotic-Stress Conditions. Plants 2020, 9, 1545; doi:10.3390/plants Scopus: индекс цитирования 11, процентиль 72; WoS: индекс цитирования 10, квартиль1
- 15. Kushnarenko S., Utegenova G., Danaeva G., Aralbaeva M. IoT-based fully automatic smart providing aseptic materials for in vitro and cryogenic collections of wild Juglans regia for genetic resources preservation // International Journal of Agricultural Resources, Governance and Ecology/ — 2021. – Vol. 17, Issue 2-4. – P. 238 – 246. IF 0.744. Scopus: индекс цитирования 0, процентиль 25; WoS: индекс цитирования 0, квартиль 3. DOI: 10.1504/IJARGE.2021.121663
- 16. Karpova O., Alexandrova A., Nargilova R., Ramazanova M., Kryldakov R., Iskakov B. AtDREB2A gene expression under control of the inducible promoter and virus 5’-untranslated regions improves tolerance to salinity in Nicotiana tabacum // International Journal of Biology and Biomedical Engineering (by NAUN). – 2021. – 15. – P. 260-274. DOI: 10.46300/91011.2021.15.32. 0.49. Scopus: индекс цитирования 0, процентиль 17.
- 17. Kushnarenko S., Aralbayeva M., Rymkhanova N., Reed B.M. Initiation pretreatment with Plant Preservative MixtureTM increases the percentage of aseptic walnut shoots // In Vitro Cellular & Developmental Biology – Plant. – 2022. IF347. Scopus: индекс цитирования 1, процентиль 74; WoS: индекс цитирования 1, квартиль 2. https://doi.org/10.1007/s11627-022-10279-4
- 18. Terletskaya N.V., Stupko V.Yu., Altayeva N.A., Kudrina N.O., Blavachinskaya I.V., Kurmanbayeva M.S., Erezhetova U. Photosynthetic activity of Triticum dicoccum × Triticum aestivum alloplasmic lines during vegetation in connection with productivitytraits under varying moister conditions. Photosynthetica 59 (1): 74-83, 2021. DOI 10.32615/ps.2021.003. Scopus: индекс цитирования 3, процентиль 49; WoS: индекс цитирования 3, квартиль 2
- 19. Alexandrova A., Karpova O., Kryldakov R., Golyaev V., Nargilova R., Iskakov B., Pooggin M.M. Virus elimination from naturally infected field cultivars of potato (Solanum tuberosum) by transgenic RNA interference // International Journal of Molecular Sciences. – 2022. – Vol. 23(14). DOI: 10.3390/ijms IF. 5.542. Scopus: индекс цитирования 0, процентиль 85; квартиль 2.
Патенты:
- 20. Пат. 2019/0952. Способ размножения лещины обыкновенной / Кушнаренко С.В., Аралбаева М.М., Ромаданова Н.В. // Министерство юстиции республики Казахстан. РГП на праве хоз. вед. «Институт биологии и биотехнологии растений» КН МОН РК. — № 4998; заявл.30.10.2019/0952.2., опубл. 05.06.20. https://gosreestr.kazpatent.kz/Utilitymodel/Details?docNumber=320230
- 21. Пат. № Способ получения оздоровленных от вирусов саженцев яблони хемотерапией / Ромаданова Н.В., Нурманов М.М., Кушнаренко С.В. // Министерство юстиции республики Казахстан. РГП на праве хоз. вед. «Институт биологии и биотехнологии растений» КН МОН РК. – № 34902; заявл.31.01.2020/0056.1., опубл. 26.02.21. https://gosreestr.kazpatent.kz/Invention/Details?docNumber=323672
Достигнутые результаты за 2023 г.: для сбора растительного материала проведены экспедиции в 5 областей Казахстана. Популяции описаны геоботаническими методами, для растений разработаны дескрипторы от 35 до 49 показателей в зависимости от вида. В местах сбора образцов зарегистрированы JPS координаты.
Начато введение побегов S. schrenckianus и P. tenella в культуру in vitro. Семена без стратификации прорастили на питательной среде Кнопа (20% асептических побегов). Семена всех собранных растений были помещены в холодильную камеру в пластиковых контейнерах для стратификации в течение 8 недель. Семена 6 образцов S. schrenckianus были помещены на стратификацию во влажном перлите на 8 недель. Начата диагностика пробирочных растений на наличие эндофитной контаминации на специализированной среде 523. В результате не выявлено эндофитной контаминации у побегов S. schrenckianus, пророщенных на среде Кнопа. Начата оптимизация питательных сред для микроклонального размножения S. schrenckianus и создание его коллекции in vitro.
Начато создание криогенного банка семян и ДНК при температуре -196°С. Семена 12 образцов S. schrenckianus были помещены в жидкий азот на длительное хранение. Из листьев M. sieversii, S. persica и L. ulmifolia были выделены тотальные ДНК, качество ДНК протестировано на электрофореграммах. В результате в криогенный банк на длительное хранение помещено 20 образцов S. persica, 16 образцов M. sieversii и 6 образцов L. ulmifolia.
Публикации (2023 г.):
- Н.В. Ромаданова, А.С. Земцова, А.М. Александрова, Н.А. Алтаева, М.М. Аралбаева, К.Т. Абидкулова, Н.В. Михайленко, А.Б. Толеген, С.В. Кушнаренко Разработка биотехнологии сохранения ex situ редких, исчезающих видов растений семейства Rosaceae, для восстановления природных популяций //27-29 ноября 2023 г. – сателлитные мероприятия, посвященные проблемам сохранения биоразнообразия редких, исчезающих видов растений; выращивания плодовых, ягодных культур, картофеля и многолетних кормовых культур, в том числе в северных регионах (в печати).
- А.С. Земцова, Н.В. Ромаданова, Н.А. Алтаева, М.М. Аралбаева, С.В. Кушнаренко. Сохранение биоразнообразия редких и исчезающих видов растений семейства Rosaceae: Spiraeanthus schrenkianus (Fisch. & C.A. Mey.) Maxim. и Sibiraea altaiensis (Laxm.) Schneid. //27-29 ноября 2023 г. – сателлитные мероприятия, посвященные проблемам сохранения биоразнообразия редких, исчезающих видов растений; выращивания плодовых, ягодных культур, картофеля и многолетних кормовых культур, в том числе в северных регионах (в печати).
- V. Romadanova, A.S. Zemtsova, A.M. Aleksandrova, N.A. Altayeva, M.M. Aralbayeva, K.T. Abidkulova, N.V. Mikhailenko, A.B. Tolegen, S.V. Kushnarenko. Development of biotechnology for ex situ conservation of rare, endangered Rosaceae species, for the restoration of natural populations //36th International Conference on Ecological Agriculture, Biodiversity &Waste Management (EABWM)/ Dec. 20-22, 2023 Bangkok (Thailand). P 16
Достигнутые результаты за 2024 год
Проведено пять экспедиций в 3 области Казахстана для сбора растительного материала в естественных местах произрастания.
В ущ. Тургень Алматинской области, Енбекшиказахского района собрано 10 образцов Malus sieversii (однолетние побеги с зимующими почками). Популяция яблони описана по международным дескрипторам по 49 показателям. Плотность популяции низкая – 62,0%. Популяция представлена большей частью разреженным лесом – 89,4%. Доминантные виды растений в месте сбора: Crataegus dsungarica, Spiraea hypericifolia, Rosa platyacantha и другие. Отмечена высокая поражаемость деревьев – 34,8% различными вредителями и болезнями, выявлены сухие погибающие деревья. Состояние деревьев в месте сбора в основном – взрослые жизнеспособные – 67,4%. Деревья популяции чаще средней высоты (5-8 м) – 52,7%.
Собрано 8 образцов Prunus ulmifolia (однолетние побеги с зимующими почками) в ущ. Коксу (Джунгарский Алатау). Популяция миндаля трехлопастного описана по международным дескрипторам по 49 показателям. Плотность популяции низкая – 100%. Поражаемость кустарников ˂ 10%. Популяция представлена средними – 50% и низкими – 50% по высоте взрослыми жизнеспособными кустарниками.
В Туркестанской области, Тюлькубасского района собрано 39 образцов Cotoneaster karatavikus: 1) 8 образцов на водохранилище Кулан; 2) 21 образец в Сайрам-Угамском Нац. Парке; 3) 8 образцов в ущ. Байжансай. Популяция описана по 48 показателям. В первом месте произрастания плотность популяции низкая, в основном это взрослые жизнеспособные кустарники (75%). Поражаемость кустарников не отмечена, плодоношение слабое. Во втором месте произрастания плотность популяции средняя, чаще встречаются молодые неплодоносящие кустарники (42,9%) и взрослые жизнеспособные кустарники (38,1%). Поражаемость кустарников низкая (10,5% некроз), у 61,9% кустарников плодоношение отсутствует. В третьем месте произрастания плотность популяции средняя, половина кустарников – молодые неплодоносящие, половина – взрослые жизнеспособные. Поражаемость кустарников не выявлена, у 50% кустарников плодоношение обильное, у 25% среднее, 25% слабое.
Собрано 3 образца Malus niedzwetzkyana: 1) Алматинская область, Уйгурский район, ущ. Большой Кыргызсай – 2 образца (взрослое больное со слабым плодоношением и молодое плодоносящее с средним плодоношением). Отмечена сильная поражаемость деревьев (65,7%) – сухие ветви, поврежденные листья и плоды. Среди вредителей идентифицированы: Cydia pomonella, Hyphantria cunea, Tetranychidae donnadieu. В Алматинской области, Илийском районе, окрестности пос. Боралдай 1 образец. Это молодое обильно плодоносящее дерево. Поражаемость 20% – бактериальный ожог (Erwinia amylovora) и яблоневая плодожорка (Cydia pomonella).
Собрано 15 образцов Malus sieversii: 1) 1 образец в Алматинской области, Уйгурского района, подгорье ущ. Большой Кыргызсай. Это молодое обильно плодоносящее дерево. Поражаемости не выявлено; 2) 13 образцов в Алматинской области, Уйгурского района, ущ. Большой Кыргызсай. Плотность популяции средняя, представленная взрослыми больными деревьями. Поражаемость – 65,7%. Большинство деревьев имеют сухие ветви, поврежденные листья и плоды, на деревьях в большом количестве имеются коконы. Среди вредителей идентифицированы: C. pomonella, H. cunea, T. donnadieu. Плодоношение: слабое – 35,7%, среднее – 42,8%; 3) 1 образец в Алматинской области, Уйгурского района, трасса Чунджа-Кольжат, 97-й километр. Это молодое средне плодоносящее дерево без признаков поражаемости.
Собран 1 образец Prunus tenella в Восточно-Казахстанской области, юго-восточная окраина г.Риддер. Это взрослый жизнеспособный кустарник со средним плодоношением, поражаемость 5% (некроз), вредители не обнаружены.
Экспедиция в Восточно-Казахстанскую область, на Калбинский хребет, пойма р. Чар была неудачной, не было обнаружено ни одного кустарника Rosa cinnamomea, все собранные 40 образцов были идентифицированы как Rosa laxa. В 2025 году планируется экспедиция в Восточно-Казахстанскую область, Прииртышье, среднее течение р. Иртыш, где отмечено произрастание еще одной популяции.
Собран 21 образец Sibiraea laevigata в Восточно Казахстанской области, в окрестностях г. Риддер, пойме реки Громотуха. В основном это взрослые жизнеспособные (90,5%) обильно плодоносящие (80,1%) кустарники. Поражаемость – 12,3% ржавчинными заболеваниями и листоедом (Syneta albida).
Всего в 2024 году собрано 97 образцов растений семейства Rosaceae, занесенных в Красную книгу. Работа будет продолжена.
Продолжено введение побегов в культуру in vitro, пророщенных из семян и однолетних побегов. Продолжена диагностика пробирочных растений на наличие эндофитной контаминации на специализированной среде 523 для детекции грибов и бактерий. Продолжена оптимизация питательных сред для микроклонального размножения и для укоренения побегов в культуре in vitro. Продолжено создание коллекции in vitro асептических растений как исходного материала для среднесрочного хранения побегов in vitro при температуре 4°С, длительного сохранения апикальных меристем при -196°С и производства саженцев.
Собранные черенки яблони и миндаля трехлопастного проращивали в лабораторных условиях при 23-25°С в воде. Проросшие из спящих почек побеги (1-2 см) стерилизовали в 0,1% HgCl2 в течение 5-7 мин и помещали в пробирки со средой Мурасиге и Скуга (МС), содержащую 30 г/л сахарозы, 0,5 мг/л 6-бензиламинопурина (БАП), 0,01 мг/л индолилмасляной кислоты (ИМК), рН 5,7. Процент введения побегов яблони в культуру in vitro в среднем составил – 62,3±10,5а, миндаля – 51,7±38,5а.
Собранные в результате экспедиций плоды 8 видов растений семейства Rosaceae были использованы для введения в культуру in vitro. Плоды стерилизовали в 50% коммерческом отбеливателе «Белизна» в течение 5 минут, после чего использовали 5 способов введения в культуру in vitro семян:
1) для семян проводили стратификацию в перлите при 4°С (8 недель) при интенсивности света 10 µE·m-2·s-1, 8-часовом фотопериоде (акклиматизация в холодных условиях (АХ);
2) семена стратифицировали (8 недель) в пластиковых контейнерах в условиях АХ;
3) семена проращивали в перлите при температуре 23-25°С, при освещении 40 µE·m-2·s-1, фотопериод 16 часов (условия светокультуральной комнаты (СК);
4) семена или зародышевые оси, проращивали в условиях СК на среде Кнопа: 1 г/л Ca(NO3)2, 0.25 г/л MgSO4*7H2O, 0.25 г/л KH2PO4, 0,125 г/л KCI, 27.8 мг/л FeSO4*7H2О, 37.3 мг/л Na2EDTA*2H2O, 1,75 г/л джелрайта, 4 г/л агара, pH 5.7;
5) семена или зародышевые оси, проращивали в условиях СК на том же составе среды МС, как для яблони и миндаля трехлопастного.
Следует отметить, что у всех образцов стратификация при 4°С увеличивала процент всхожести семян. Проращивание семян in vitro на среде MС давало стабильно низкие результаты всхожести во всех вариантах. Полученные из семян, проросшие в перлите побеги (1-2 см), стерилизовали в 0,1% HgCl2 в течение 3-5 мин и помещали в пробирки со средой МС с различными концентрациями фитогормонов, в данный момент проводится оптимизация состава питательных сред. В результате процент введения в культуру in vitro семян Cotoneaster karatavikus (3 формы) в среднем составил – 47,9%, Crataegus ambigua – 45,3% (5 форм), Malus niedzwetzkyana – 52,4% (2 формы), M. sieversii – 60% (8 форм), Prunus tenella – 45% (2 формы), P. triloba – 56,7% (5 форм), Sibiraea laevigata – 40% (3 формы), Spiraeanthus schrenckianus – 88,3% (6 форм).
Продолжена диагностика пробирочных растений на наличие эндофитной контаминации на специализированной среде 523 для детекции грибов и бактерий: 10 г/л сахарозы, 8 г/л гидролизата казеина, 4 г/л дрожжевого экстракта, 2 г/л KH2PO4, 0,15 г/л MgSO4·7H2O, 6 г/л джелрайта, рН 6,9. В результате не выявлено эндофитной контаминации у побегов S. Schrenckianus – 0±0a и S. laevigata – 0±0a, для M. sieversii процент контаминации в среднем составил – 51,7±38,5b, для C. ambigua – 45,0±22,2b, для P. tenella – 25,4±20,1b, для P. triloba – 28,4±26,4b. Начата оптимизация состава питательных сред для микроклонального размножения и создание коллекции in vitro. На данный момент максимальный коэффициент размножения (КР) – 2,9 для S. schrenckianus был получен на среде МС с 0,1 мг/л БАП, 0,01 мг/л ИМК; для S. laevigata КР 4,6 был получен на среде: МС с добавлением 1,0 мг/л БАП, 0,01 мг/л ИМК, 0,1 мл/л ГК; для M. sieversii КР 3,9 на среде: МС с добавлением 0,5 мг/л БАП, 0,01 мг/л ИМК; для C. ambigua КР 2,0 на среде: МС с 0,2 мг/л БАП и 0,01 мг/л ИМК; для P. tenella КР 2,8 на среде МС с 1,0 мл/л БАП, для P. riloba КР 3,9 на среде МС с 1,0 мл/л БАП. Начато перемещение созданных in vitro коллекций M. sieversii и P. riloba на среднесрочное хранение при температуре 4°С.
Начато создание криогенного банка семян. Семена по 10-50 шт. без предварительной обработки помещали в пакеты из ламинированной алюминиевой фольги и замораживали при -20°С или семена помещали в криопробирки и сохраняли при -196°С. В результате в морозильную камеру при -20° было помещено 46 образцов семян: C. ambigua (19 форм), M. sieversii (5), S. laevigata (2), S. schrenckianus (20). В криогенный банк при -196°С помещено 246 образцов: C. ambigua (40 форм/120 образцов), M. sieversii (19/57), S. laevigata (3/9), S. schrenckianus (20/60).
Начато создание криогенного банка ДНК. Для выбора оптимального метода экстракции геномной ДНК из листьев были протестированы три стандартных протокола, широко используемых для растительных объектов. Для всех образцов был оптимален протокол, разработанный Дойл и Дойл. Проверку качества и количества выделенной геномной ДНК проводили электрофорезом в 1,2% агарозном геле. В результате было выделено 552 образца тотальной ДНК из 7 видов растений семейства Розоцветных (C. ambigua (40 форм/120 образцов), M. sieversii (26/78), P. tenella (12/36), P. ulmifolia (3/9), S. laevigata (11/33), S. persica (24/72 S. schrenckianus (13/39). ДНК поместили в криогенный банк при (-196°С) для длительного хранения.
Для C. ambigua, M. sieversii, P. ulmifolia S. laevigata, S. schrenckianus разработан протокол перевода побегов in vitro в почвенный субстрат. Для этого побеги предварительно укореняли в in vitro СУ на питательной среде: ½МС, с 30 г/л сахарозы, 0,5 мг/л БАП, 0,25 мг/л ИМК, рН 5,7. Укореняемость в культуре in vitro составила от 56,7 до 100,0%. Укорененные in vitro побеги (длина корней – 2,5-8,0 см) переносили в полиэтиленовые контейнеры объемом 250 мл c грунтом следующего состава: смесь чернозема, торфа, перлита в процентном соотношении: 50:40:10. Контейнеры закрывали пластиковой прозрачной крышкой для сохранения влаги, необходимой для адаптации побегов. Саженцы адаптировали в теплице (температура от 18°С до 24°С, влажность 40% без дополнительного освещения. Через неделю пластиковый колпак снимали на 10-15 минут для проветривания растений, в последующие дни продолжительность проветривания увеличивали до 8 часов. Продолжительность адаптации составляла от 3 до 6 недель. Для последующей адаптации пластиковые колпаки снимали. В результате приживаемость посадочного материала в теплице составила от 76,4 до 94,2%.
В полиэтиленовые контейнеры с торфом после 7 месяцев хранения при 4°С были высажены семена 3 форм C. ambigua, 3 форм M. sieversii, 4 форм S. laevigata, 4 форм S. schrenckianus. Процент прорастания в результате составил у C. ambigua 69,7±22,1a, у M. sieversii 76,7±32,2a, у S. schrenckianus 29,7±17,3b у S. laevigata 38,4±23,6b, что значительно ниже процента прорастания семян сразу после сбора и или после стратификации. Соответственно, всхожесть семян после 7 месяцев хранения при 4°С снижается у S. laevigata почти в 3 раза, а у S. schrenckianus в больше чем в 2 раза, у. M. sieversii в 1,3 раза, у C. ambigua в 1,7 раз. Полученные в результате работы саженцы и сеянцы будут дорощены и интродуцированы в природные условия для восстановления деградиртующих популяций.
 Рисунок 1. Общий вид растений семейства Rosaceae на территории произрастания, плоды и гербарии. A) Cotoneaster karatavicus (Популяция 1 (П1); Б) Crataegus ambigua (П3); В) Malus sieversii (П2); Г) Prunus tenella (П1); Д) Sibiraea laevigata (П1); Е) Spiraeanthus schrenckianus (П1)
Рисунок 1. Общий вид растений семейства Rosaceae на территории произрастания, плоды и гербарии. A) Cotoneaster karatavicus (Популяция 1 (П1); Б) Crataegus ambigua (П3); В) Malus sieversii (П2); Г) Prunus tenella (П1); Д) Sibiraea laevigata (П1); Е) Spiraeanthus schrenckianus (П1)
 Рисунок 2. Введение в культуру in vitro растений семейства Rosaceae (семена. Черенки, in vitro побеги, тестирование in vitro побегов на среде 523). A) Prunus ulmifolia; Б) Spiraeanthus schrenckianus; В) Malus sieversii; Г) Sibiraea laevigata; Д) Crataegus ambigua; Е) Prunus tenella
Рисунок 2. Введение в культуру in vitro растений семейства Rosaceae (семена. Черенки, in vitro побеги, тестирование in vitro побегов на среде 523). A) Prunus ulmifolia; Б) Spiraeanthus schrenckianus; В) Malus sieversii; Г) Sibiraea laevigata; Д) Crataegus ambigua; Е) Prunus tenella
Результаты за 2025 г.
В ходе экспедиций 2023-2025 гг. в различных регионах Казахстана была зафиксирована значительная морфологическая вариативность среди девяти видов семейства Rosaceae – от полукустарников высотой 40 см (S. laevigata) до деревьев 5-8 м (M. sieversii). Всего собрано 288 образцов из естественных местообитаний, преимущественно каменистых склонов на высотах 4-1883 м над уровнем моря. Отмечено слабое плодоношение in situ, с варьированием типов плодов по размеру и окраске.
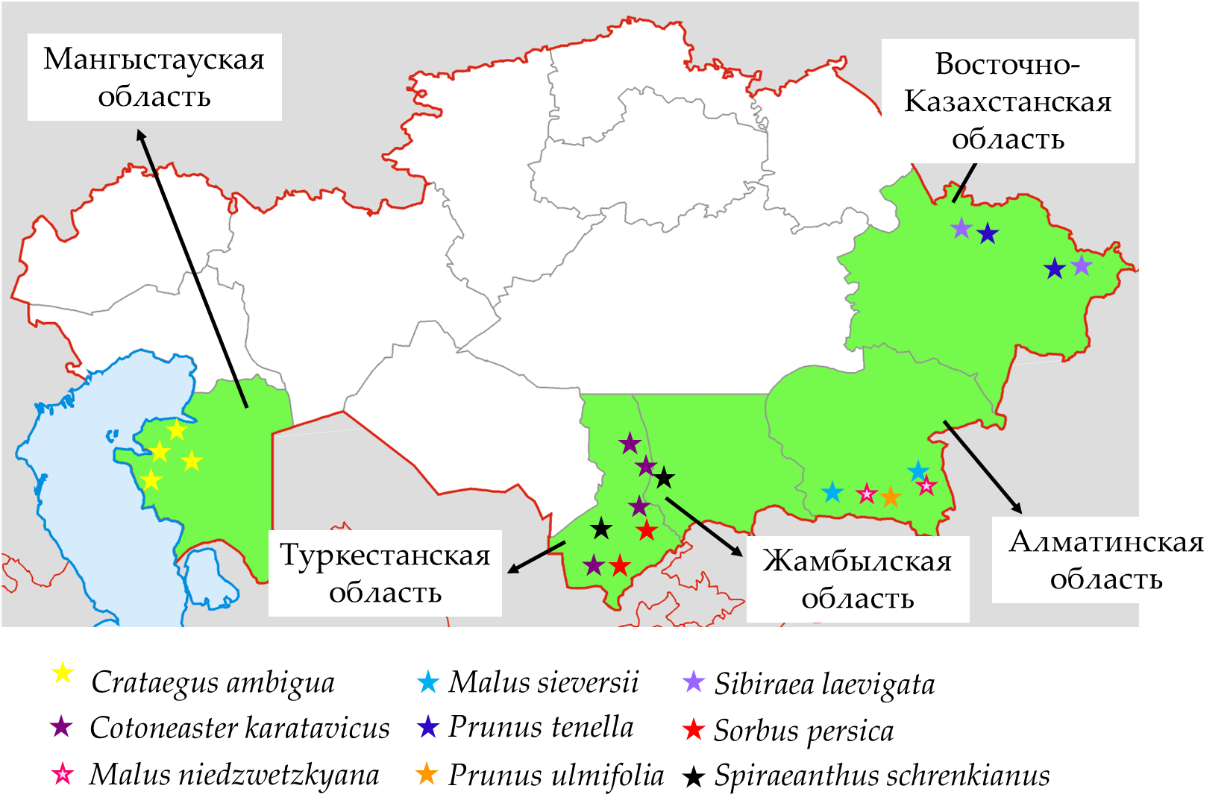
Места сбора образцов краснокнижных растений семейства Rosaceae во время полевых экспедиций в Казахстане в 2023-2025 гг. Места сбора отмечены зелёным цветом, а виды представлены цветными звёздами
Все растения были охарактеризованы и пронумерованы. Выделено: 3 популяции C. karatavicus – жизнеспособные, вечнозелёные взрослые растения, с низкой поражаемостью болезнями и вредителями. 6 популяций C. ambigua – жизнеспособные плодоносящие кустарники; более 50% листовой массы повреждено насекомыми. 4 экземпляра M. niedzwetzkyana в составе 3 популяций – молодые и взрослые деревья, сильно заражённые насекомыми и поражённые бактериальным ожогом. 5 популяций M. sieversii – зрелые и молодые плодоносящие деревья, включая ослабленные и больные особи. Популяции P. tenella – 70% кустов жизнеспособны (плодоносящие и неплодоносящие), болезней не выявлено. 1 популяция P. ulmifolia – жизнеспособные молодые и взрослые кустарники с плодоношением. Популяции S. laevigata – 95% кустов плодоносят, умеренное поражение тлёй (Aphis pomi) и грибными болезнями. 2 популяции S. persica – неплодоносящие молодые и взрослые деревья, умеренное поражение ржавчиной. 2 популяции S. schrenkianus – почти все кустарники взрослые, плодоносящие, заболевания отсутствуют. Отдельные экспедиции не выявили Rosa pavlovii (Чарск) и Sibiraea tianschanica (ущелье Сумбе).
Пять видов Rosaceae были успешно введены в культуру in vitro с использованием семян и зародышевых осей. Стратификация при 4 °C повышала прорастание. Наилучшие результаты стерилизации (HgCl₂, 4-7 мин) и среды (Кнопа) варьировались по видам: C. ambigua – до 52,6% побегов. M. sieversii – до 53,9%, лучший результат – после стерилизации семян и проращивания ex vitro. S. laevigata – до 61,5%, успешное проращивание как in vitro, так и ex vitro. P. tenella – до 44,3%. S. schrenkianus – до 41,1%. Среда МС уступала по результативности среде Кнопа. Побеги, пророщенные из черенков M. sieversii и P. ulmifolia показали высокие показатели инициации (до 62%). Эндофитная контаминация на среде 523 у варьировала от 0 до 85%; у S. laevigata и S. schrenkianus – без признаков инфицирования.
Для микроклонального размножения использовались различные варианты среды МС. Средние коэффициенты размножения (КР): C. ambigua – 1,8 (макс. 3,5 при добавлении Fe, витамина С и снижении БАП). P. tenella – 2,3 (макс. 3,2 при снижении БАП до 0,25 мг/л). S. laevigata – до 5,5 при высоком соотношении ауксин/цитокинин. S. schrenkianus – до 4,0.
Влияние состава питательной среды на коэффициент размножения (КР) побегов в культуре тканей видов семейства Rosaceae
| Вариант питательной среды | Наименование образца, КР | ||||
| Crataegus ambigua | Prunus tenella | Prunus ulmifolia | Sibiraea laevigata | Spiraeanthus schrenckianus | |
| 1 | 1,2±0,1e | 2,8±0,3cd | 2,8±0,4cd | 2,6±0,5cd | 1,2±0,4e |
| 2 | 1,8±0,2de | 2,0±0,3d | 2,5±0,5cd | 3,0±0,4c | 1,0±0,4e |
| 3 | 1,0±0,1e | 2,5±0,4cd | 3,5±0,7b | 4,4±0,9b | 1,3±0,3e |
| 4 | 1,2±0,3e | 1,5±0,2de | 3,1±0,8bc | 5,5±1,6a | 1,0±0,1e |
| 5 | 1,1±0,1e | 1,8±0,3de | 2,0±0,3d | 2,6±0,5cd | 1,2±0,4e |
| 6 | 1,2±0,3e | 1,7±0,2de | — | 5,0±1,5ab | 3,5±0,7b |
| 7 | 1,0±0,1e | 1,8±0,8de | — | 4,6±1,1ab | 4,0±0,9b |
| 8 | 2,7±0,4cd | 2,4±0,3cd | — | 5,5±1,4a | — |
| 9 | 3,3±0,5b | 2,6±0,5cd | — | — | — |
| 10 | 3,5±0,7b | 2,9±0,6cd | — | — | — |
| 11 | — | 3,2±0,8bc | — | — | — |
| 12 | — | 2,8±0,3cd | — | — | — |
| 13 | — | 2,2±0,2d | — | — | — |
| Ср. знач. ± ст. откл | 1,8±1,0 | 2,3±0,8 | 2,8±1,1 | 4,2±1,2 | 1,9±1,3 |
Данные представлены как среднее значение ± стандартная ошибка (SE). Значения, помеченные разными буквами в пределах одного блока, статистически различаются при уровне значимости p ≤ 0,05 согласно критерию Тьюки для множественного сравнения средних.
Сравнительное хранение побегов in vitro при 4 °C и 10 °C в течение 8 месяцев показало: M. sieversii – LT₅₀ >50% только при 4 °C (свыше 8 месяцев); P. ulmifolia –оптимально 6 месяцев при 10 °C. S. laevigata – до 5 месяцев без значимых различий. S. schrenkianus – LT₅₀ >50% при обоих режимах.
Семена M. niedzwetzkyana, M. sieversii, S. laevigata и S. schrenkianus были успешно сохранены при -20 °C и -196 °C (422 образца). Использован упрощённый протокол без использования криопротекторов. Жизнеспособнлсть достигала 94%. Впервые криосохранены семена S. laevigata и S. schrenkianus. обеспечил выживаемость до 80% (у M. sieversii).
Оптимизирован протокол криосохранения зародышевых осей со средней регенерацией 65,7%. Создан криогенный банк, состоящий из 39 образцов).
ДНК извлечена и сохранена в жидком азоте для восьми видов. Качество (A260/280) варьировало от 1,6 до 1,9. Создан криогенны банк, состоящий из 621 образца.
В процессе криоконсервации предварительная адаптация к пониженной температуре увеличивала выживаемость апикальных меристем у S. schrenkianus и P. ulmifolia (до 83,3% после 100-минутной обработки). Создан криогенный банк 8 образцов.

A– Апикальная меристема S. schrenckianus при 60 кратном увеличении; Б – Регенерация апикальных меристем S. schrenckianus после криоконсервации; В – Апикальная меристема P. ulmifolia при 30 кратном увеличении; Г– Регенерация апикальных меристем P. ulmifolia после криоконсервации
Оптимизация протокола криоконсервации апикальных меристем растений семейства Rosaceae: P. ulmifolia и S. Schrenckianus методом PVS2 витрификации: акклиматизация холодом при переменных температурах – 6 недель, в криопротекторе PVS2 – 100 минут
Наилучшие результаты укоренения S. schrenkianus (71,4%) достигнуты на ½МС с ИМК (0,4 мг/л) и перлитом. У P. ulmifolia – до 94,5% на среде с вермикулитом и ИМК (0,5 мг/л). Адаптация укоренённых растений в теплице достигала 94,4%. Семенное размножение также эффективно: адаптация до 96,7% у S. laevigata, до 92,4% у S. schrenkianus. Тем не менее метод получения саженцев через in vitro побеги, сохраняет значимость и не может быть исключён из практики, особенно когда семенной материал недоступен или непродуктивен, а также при необходимости сохранения и воспроизводства ценных отобранных форм, обладающих желательными признаками и генетикой родительских генотипов.
Адаптированные саженцы, полученные из культуры in vitro и из семян были высажены в природные условия для восстановления деградирующих популяций – в Иле-Алатауском нацпарке и в ущелье Малый Аксу (лесхоз «Карадала»).

А – На территории Иле-Алатауского национального парка вблизи посёлка Бескайнар Алматинской области; Б – В ущ. Малый Аксу лесного хозяйства «Кардала» Уйгурского района Алматинской области
Посадка саженцев в естественные условия образцов семейства Rosaceae
Баллы за заключительный отчет – 30
Информация для потенциальных пользователей
Полученный посадочный материал растений семейства Rosaceae, как из культуры in vitro, так и из семян, был использован для интродукции в природную среду с целью восстановления деградирующих природных популяций. Высадка саженцев была осуществлена на территории Иле-Алатауского национального парка вблизи посёлка Бескайнар (Алматинская область), а также в ущелье Малый Аксу в пределах лесного хозяйства «Карадала» Уйгурского района Алматинской области. Данная работа имеет важное значение, поскольку способствует сохранению биоразнообразия, восстановлению численности редких и уязвимых видов, а также укреплению популяционной устойчивости в условиях нарастающего антропогенного давления и изменения климата. Использование генетически идентифицированного и адаптированного посадочного материала обеспечивает большую выживаемость и экологическую совместимость интродуцированных растений, повышая эффективность мероприятий по восстановлению природных экосистем.
Публикации 2025 г.
Список публикаций в рецензируемых зарубежных научных изданиях, индексируемых в базах данных Web of Science и (или) Scopus
- Romadanova N.V., Zemtsova A.S., Altayeva N.A., Artimovich N.A., Alexandrova A.M., Kushnarenko S.V., Bettoni J.C. Geobotanical Study and Preservation of Rare and Endangered Rosaceae Species. // – Plants. – 2025. 14(10), 1526. https://doi.org/10.3390/plants14101526. Q1, Scopus процентиль 91.
Статьи в рецензируемом отечественном издании с ненулевым импакт-фактором (рекомендованном КОКСНВО МНВО РК)
- Земцова А.С., Алтаева Н.А., Аралбаева М.М., Артимович Н.А., Төлеген А.Б., Кушнаренко С.В., Сатеков Е.Я., Премина Н.В., Ромаданова Н.В. Изучение и создание коллекций in vitro редких исчезающих растений семейства Rosaceae // Труды по прикладной ботанике/ Proceedings on Applied Botany, Genetics and Breeding. – 2025. – Т. 186(3). – С. 37-56. https://doi.org/10.30901/2227-8834-2025-3-37-56. Scopus процентиль 12.
Тезисы международной конференции (с указанием формы доклада)
- Romadanova N.V., Zemtsova A.S., Artimovich N.A., Altayeva N.A., Aralbayeva M.M., Tolegen A.B., Kushnarenko S.V. Geobotanical exploration into the populations and the creation of in vitro collections of rare and endangered species within the Rosaceae family // The 14th World Gene Convention-2025 (WGC-2025). International Exchange of Professionals – Thematic Event in Life Science & The 13th Anniversary World DNA Day 2025. Nara, Japan, 2025. – P 42. https://www.bitcongress.com/bookapril/uploads/2025-04-07/9.pdf (Устный доклад)
- Romadanova N.V., Zemtsova A.S., Aralbayeva M.M., Altayeva N.A., Artimovich N.A., Kushnarenko S.V. Creation of in vitro collection of rare endangered Rosacea species for genetic resources conservation // New biotechnology – 2025. – Vol. 85. – P. 188. https://doi.org/10.1016/j.nbt.2024.08.280. Q1, Scopus процентиль 88,4. (Постерный доклад)
- Romadanova N.V., ZemtsovaA.S., Altayeva N.A., Artimovich N.A., Alexandrova A.M., Tolegen A.B., Kushnarenko S.V. Gene pool preservation of rare endangered Rosaceae plants // “3rd International Symposium on the Frontiers of Plant Biodiversity Conservation Research in the Pan-Third Pole Region”. – 2025. – P. 67. (Постерный доклад)


